Per determinare se un acido è forte o debole, è possibile considerare diversi fattori: 1. Dissociazione ionica. Un acido forte si dissocia completamente in soluzione acquosa, producendo un elevato numero di ioni H+. Un acido debole, invece, si dissocia solo parzialmente, generando un numero limitato di ioni H+. 2.. Per determinare se un acido è forte o debole, è possibile considerare diversi fattori: 1. Dissociazione ionica. Un acido forte si dissocia completamente in soluzione acquosa, producendo un elevato numero di ioni H+. Un acido debole, invece, si dissocia solo parzialmente, generando un numero limitato di ioni H+. 2.

Diluendo soluzioni di un acido forte o debole
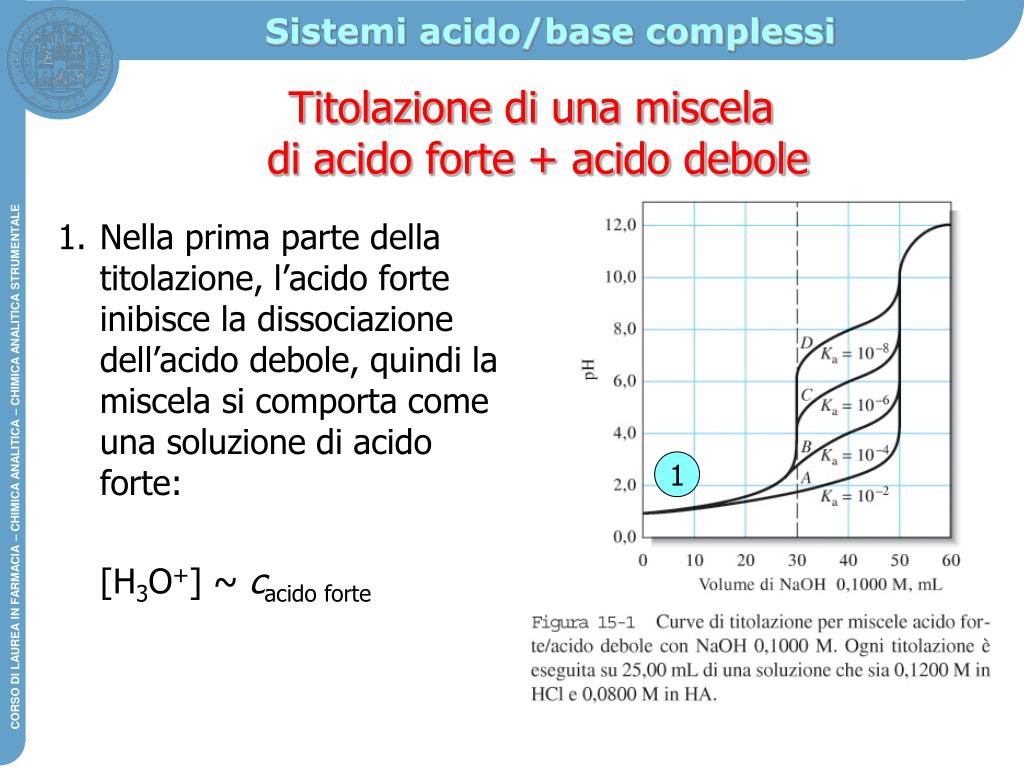
Grafico Titolazione Acido Debole Base Forte oqudina
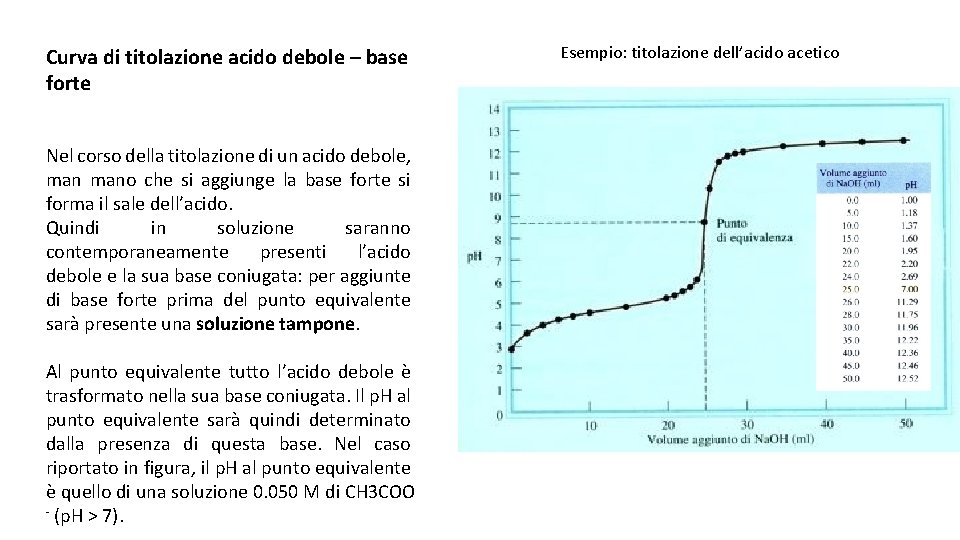
Curva di titolazione acido debole base forte Nel
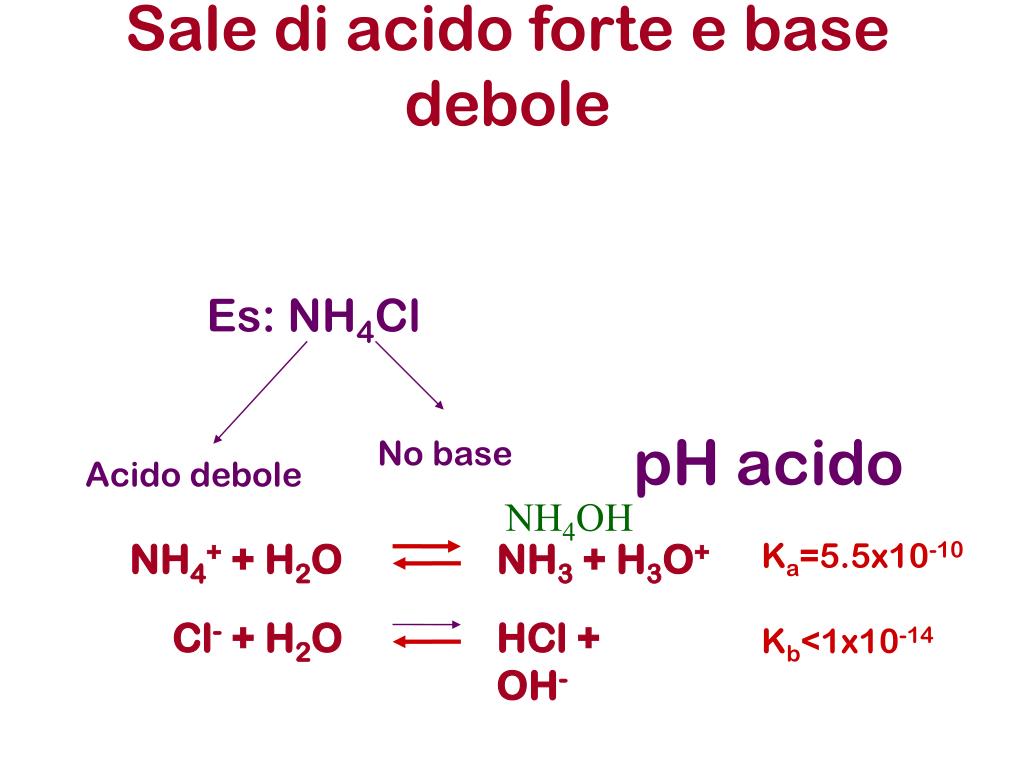
PPT Acidi e basi PowerPoint Presentation, free download ID3735361

Hcl Acido Forte O Debole princeselsa
CH3COOH molécula de ácido acético 2022
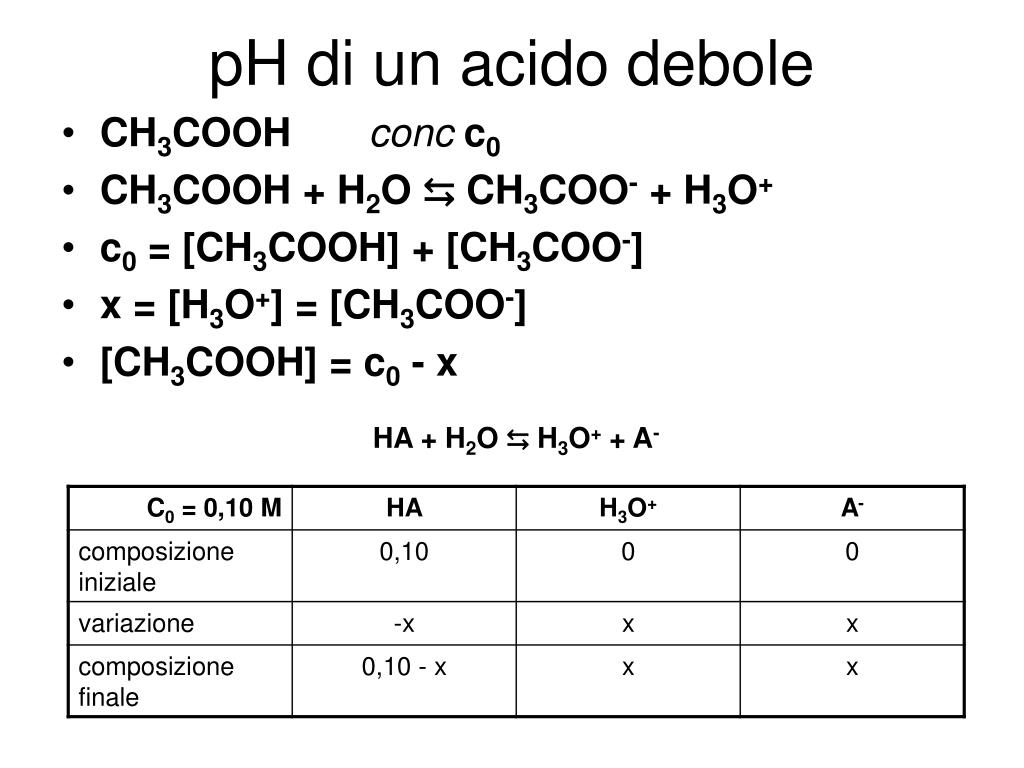
PPT Soluzione di un acido debole PowerPoint Presentation, free download ID5120358
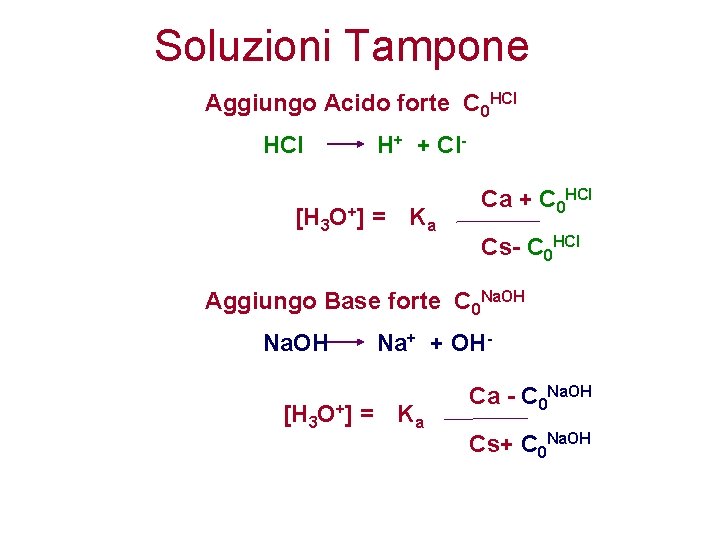
Diluendo soluzioni di un acido forte o debole

Diluendo soluzioni di un acido forte o debole

Diluendo soluzioni di un acido forte o debole

Diluendo soluzioni di un acido forte o debole

PPT curva di titolazione base deboleacido forte PowerPoint Presentation ID4898016

ACIDI E BASI FORTI E DEBOLI YouTube

Diluendo soluzioni di un acido forte o debole

PPT curva di titolazione acido debolebase forte PowerPoint Presentation ID4911919
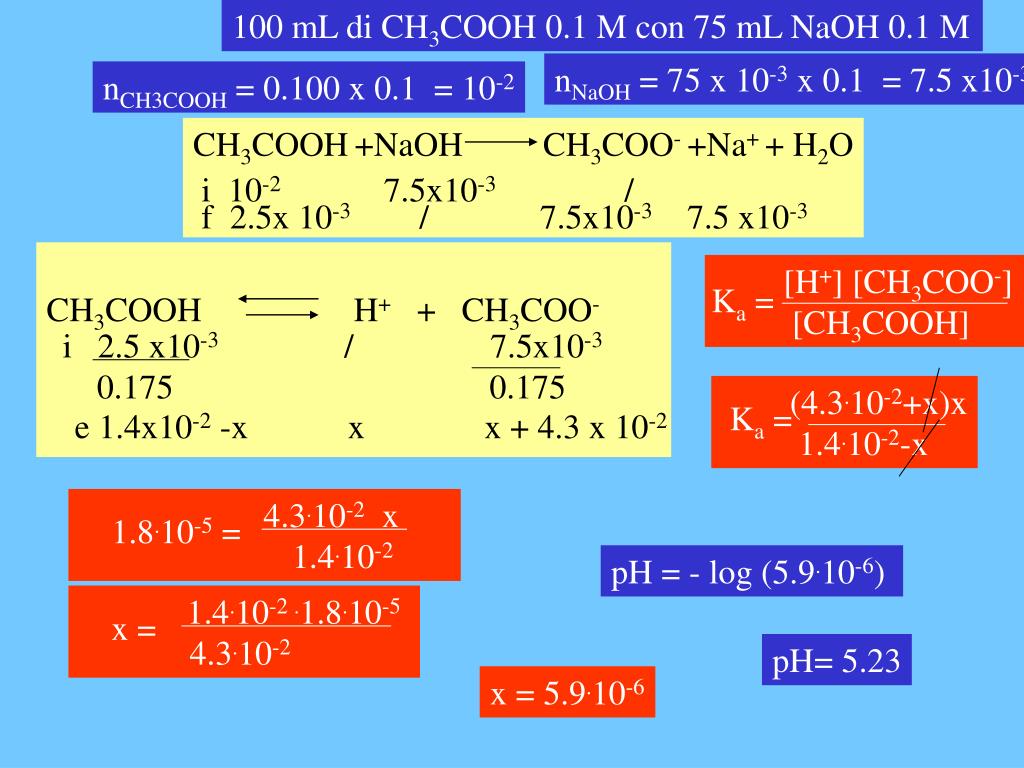
PPT curva di titolazione acido debolebase forte PowerPoint Presentation ID4911919

Diluendo soluzioni di un acido forte o debole

PPT Capitolo 7 Acidi e Basi PowerPoint Presentation, free download ID6574457
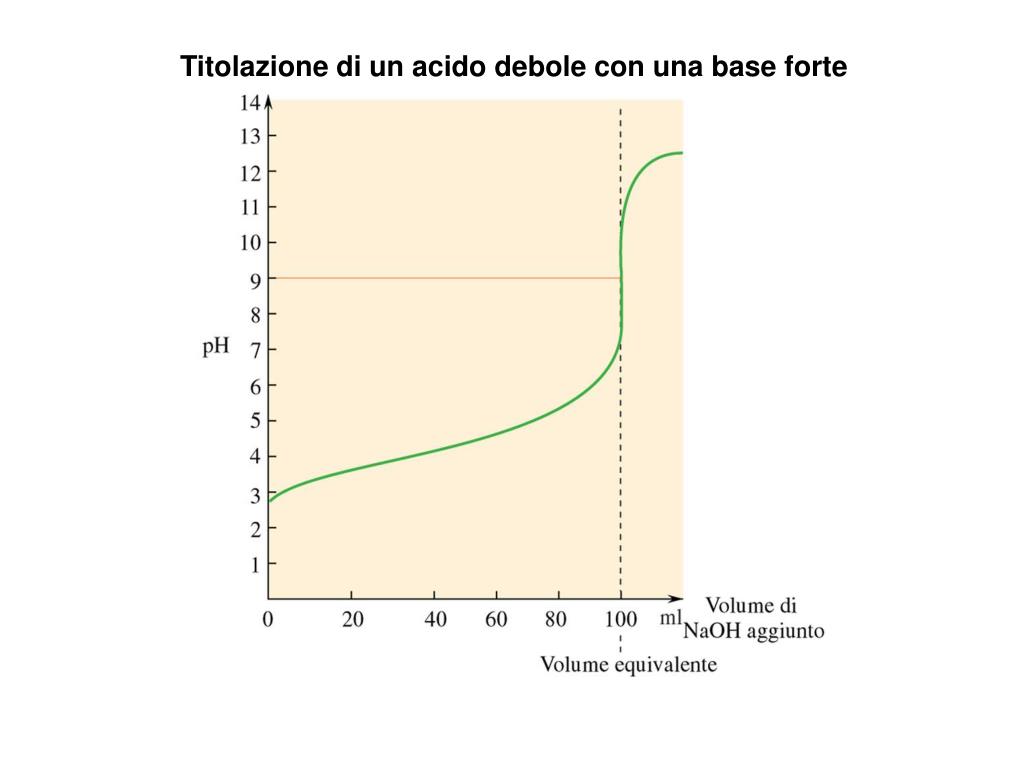
PPT Titolazione di un acido forte con una base forte PowerPoint Presentation ID6260029
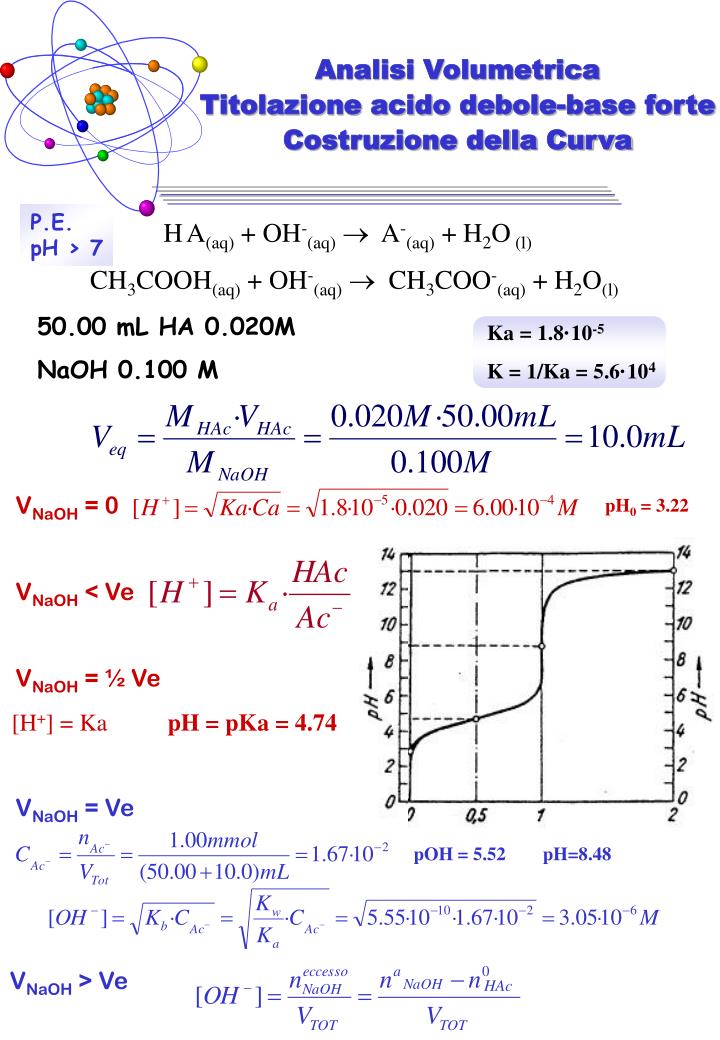
PPT Titolazione acido fortebase forte HClNaOH PowerPoint Presentation ID3571283
Per determinare se un acido è forte o debole, è possibile considerare diversi fattori: 1. Dissociazione ionica. Un acido forte si dissocia completamente in soluzione acquosa, producendo un elevato numero di ioni H+. Un acido debole, invece, si dissocia solo parzialmente, generando un numero limitato di ioni H+. 2.. Il primo elemento, ovvero l'acido acetico può rappresentare l'acido debole che in acqua è poco dissociato, mentre il secondo, ovvero l'acetato di sodio, è un elettrolita forte che in acqua è.