Introducción a la entalpía de reacción. En un experimento, un estudiante agrega 100. mL de 1.00 M HCl ( a q) a 2.43 g de Mg ( s) , lo que resulta en la formación de un gas. Arriba se muestra la ecuación balanceada de la reacción. ¿Cuál de las siguientes opciones muestra el reactivo limitante y la cantidad de calor liberado, q , en el.. Para completar el proceso correspondiente al cambio de entalpía estándar, sin embargo, también debemos separar los productos y llevarlos a una presión de 1 bar. Es decir, la entalpía estándar de reacción y el cambio de entalpía que mediríamos están relacionados por la siguiente secuencia de cambios, donde la ecuación media.

ENTALPÍA DE REACCIÓN YouTube

Variación de entalpía » Recursos educativos digitales
Termoquimica

Entalpia de Reacción a 298K Ejercicio 1 YouTube
Que Es La Entalpia De Formacion bourque

Calculo de entalpía de reacción. Ley de Hess BACHILLERATO YouTube

015.Problemas Termoquímica. Determinación entalpía de reacción a partir de entalpías de

Que Es Entalpia En Quimica delevio

ENTALPÍA DE REACCIÓN (EXOTÉRMICAS Y ENDOTÉRMICAS) YouTube

entalpia termodinamica entalpía símbolo Kellydli

Entalpía qué es, características y reacciones químicas Meteorología en Red

Entalpía es una magnitud termodinámica, simbolizada con la letra H mayú

Que Es Entalpia En Quimica escuela

Entalpia de reaccion a partir de otras reacciones Quimica 2 Bachillerato AINTE YouTube

009.Problemas Termoquímica. Ecuación Termoquímica y Entalpía de reacción YouTube
[Solved] Ejercicio asignado Determine la entalpia de reaccion mediante... Course Hero

Entalpía qué es, características y reacciones químicas Meteorología en Red

Entalpía de reacción qué es, termoquímica, ejercicios resueltos

CÁLCULO DE LAS ENTALPÍAS DE REACCIÓN Entalpía de formación estandar YouTube

Cálculo de la entalpía de reacción. Ejemplo resuelto 2 YouTube
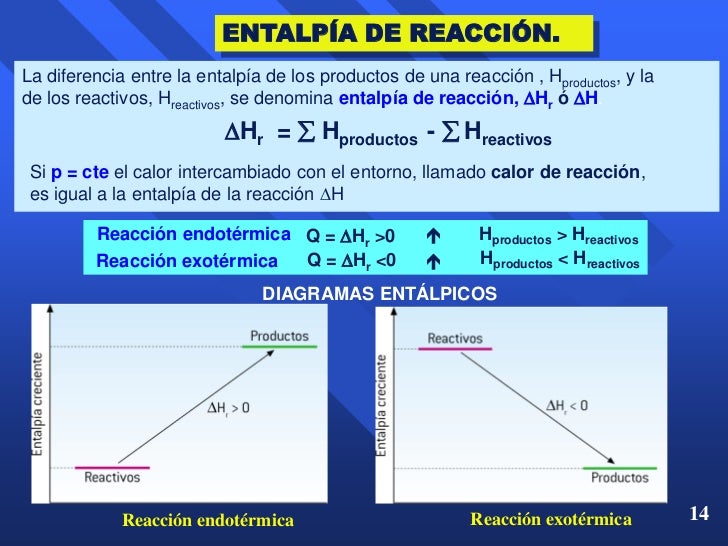
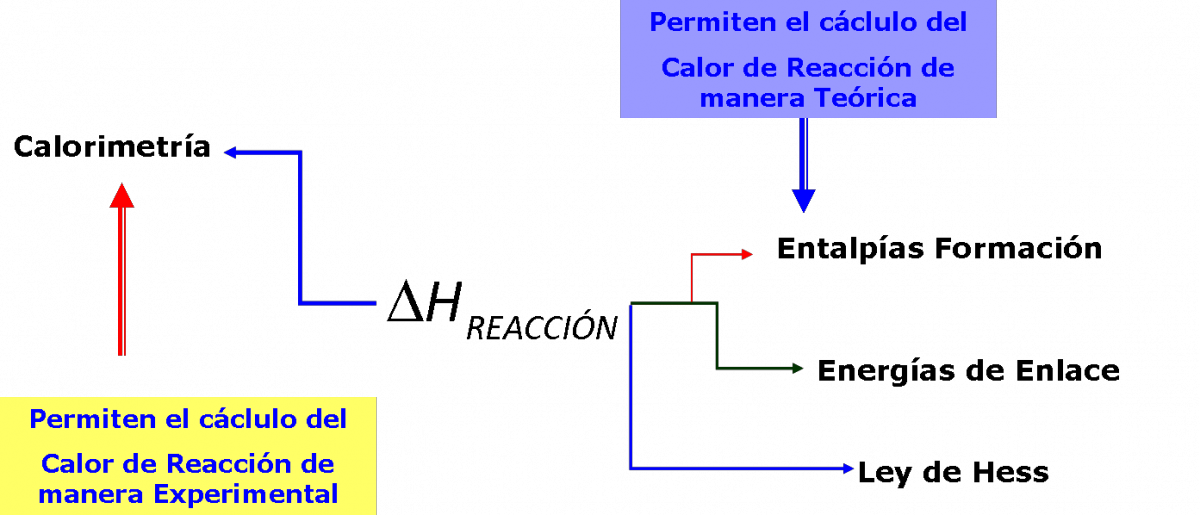
De acuerdo con la estequiometría de la reacción, exactamente se formarán 0.25 mol de CaF 2, por lo que esta cantidad de calor es para 0.25 mol. Para 1 mol de CaF 2, necesitamos escalar el calor en un factor de cuatro: q = 4.400 J × 4 = 17.600 J por 1 mol CaF 2. Sobre una base molar, el cambio en la entalpía es. Δ H = −17.600 J = −17.6 kJ. Entalpía de reacción. En las reacciones químicas, los enlaces entre átomos pueden romperse, reconstituirse o experimentar ambos procesos, ya sea para absorber o liberar energía. El resultado es un cambio de la energía potencial del sistema. El calor que absorbe o libera un sistema sometido a presión constante se conoce como entalpía, y.